Spunti di riflessione sui fattori immunitari del dolore intestinale
14 Febbraio 2021Il dolore intestinale debilitante è comune, ma la causa sottostante è spesso poco chiara. Emerge che l’infezione intestinale innesca risposte immunitarie localizzate che inducono a percepire come dannosi cibi normalmente innocui, portando a dolore persistente.
Stuart M. Brierley
Stuart M. Brierley fa parte del College of Medicine and Public Health, Flinders Health and Medical Research Institute, Flinders University, Adelaide, South Australia 5042, Australia, e presso l’Hopwood Centre for Neurobiology, South Australian Health and Medical Research Institute, Adelaide.
https://www.nature.com/search?order=date_desc&q=%22Stuart+M.%2BBrierley%22
Il dolore si è evoluto per avvisarci e proteggerci da danni ai tessuti effettivi o potenziali. Esistono tre forme comuni: dolore nocicettivo, che è associato alla rilevazione di stimoli dannosi; dolore infiammatorio, associato a infiammazione o infezione; e il dolore cronico, che è una forma di dolore disadattivo a lungo termine 1 . Scrivendo in Nature , Aguilera-Lizarraga et al. 2 riportano prove di topi e umani che indicano un meccanismo precedentemente sconosciuto che contribuisce al dolore intestinale cronico.Leggi l’articolo: La risposta immunitaria locale agli antigeni alimentari determina il dolore addominale indotto dal pasto
Quando un individuo ha una ferita evidente, come un braccio rotto, possiamo facilmente capire che sta soffrendo. Ma se il sito della lesione non può essere facilmente individuato, può essere difficile determinare l’origine del dolore. Questo è un problema comune per le persone che hanno dolore agli organi interni, con alcune forme di tale dolore più facili da diagnosticare rispetto ad altre. Ad esempio, le persone che hanno una malattia infiammatoria intestinale potrebbero avere indicatori di malattia facili da individuare, come sanguinamento gastrointestinale, infiammazione del rivestimento intestinale o presenza di molecole di biomarcatori distintivi in campioni di feci o sangue 3 . Tuttavia, le persone che hanno la sindrome dell’intestino irritabile (IBS), una condizione che colpisce l’11% della popolazione mondiale 4, mancano di tali chiari segni distintivi della malattia e nessuna causa evidente spiega il loro dolore addominale cronico e la concomitante stitichezza o diarrea.
Studi precedenti indicano che l’IBS è più comune nelle donne che negli uomini 4 , con sintomi di IBS innescati da fattori come stress 4 , gastroenterite (una malattia causata dall’ingestione di cibo o acqua contaminati) 4 , alterazioni nei microrganismi intestinali 5 e cambiamenti nella comunicazione tra l’intestino e il cervello 6 . Aguilera-Lizarraga et al. ora mostrano che un’infezione batterica intestinale può modificare profondamente le risposte immunitarie locali nell’intestino, con il risultato che alcuni alimenti vengono percepiti come dannosi e quindi causano dolore intestinale persistente (Fig. 1).
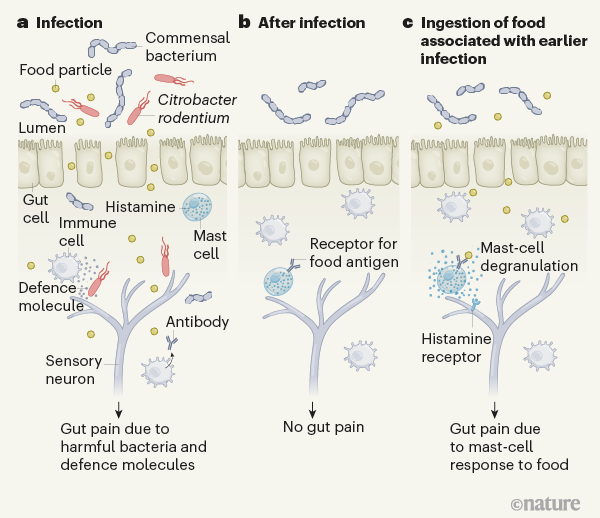
Negli individui sani, un processo chiamato tolleranza orale fa sì che il sistema immunitario ‘ignori’ le sostanze assunte per via orale 7 , 8. Un’eccezione a questa tolleranza si verifica per le sostanze percepite dal nostro corpo come pericolose, come batteri nocivi (patogeni), parassiti e virus. I nostri corpi identificano gli invasori estranei rilevando frammenti molecolari chiamati antigeni, che forniscono un tipo di “codice a barre” che consente al nostro sistema immunitario di identificare specificamente gli intrusi. Il nostro sistema immunitario può etichettare questi antigeni producendo anticorpi che li riconoscono, consentendo al patogeno di essere rapidamente mirato se si ripresenta. Le nostre difese dovrebbero concentrarsi solo sui “cattivi” e lasciare in pace gli spettatori innocenti. Tuttavia, Aguilera-Lizarraga e colleghi hanno ipotizzato che un fallimento nella tolleranza orale potrebbe comportare un targeting indiscriminato sia dell’amico che del nemico.
Per determinare come questa proposta ripartizione della tolleranza potrebbe verificarsi nei topi, il team ha utilizzato un sistema modello che ha sfruttato il batterio patogeno Citrobacter rodentium e l’ovoalbumina, una proteina presente nel bianco d’uovo. L’ingestione ripetuta di ovoalbumina da sola non ha evocato segni di dolore intestinale, come determinato dalla misurazione delle contrazioni addominali in risposta alla distensione del colon e del retto degli animali. Tuttavia, la somministrazione di ovoalbumina dopo che i topi si erano ripresi da un’infezione da C. rodentium accompagnata da ovoalbumina alimentare ha causato dolore intestinale e diarrea.
Gli animali avevano anche una “permeabilità intestinale”, come dimostrato da una permeabilità intestinale superiore al normale. Questa scoperta suggerisce che il rivestimento intestinale non ha fornito la sua normale funzione di barriera fisica, e invece ha permesso al contenuto intestinale di accedere al tessuto sottostante, innescando così una risposta immunitaria e attivando i nervi sensoriali. Inoltre, gli autori hanno scoperto che anticorpi specifici contro l’ovoalbumina erano presenti nel colon ma non in altre parti del corpo.Identificazione dei microbi intestinali che influiscono sulla salute umana
L’aumento del dolore intestinale sperimentato dagli animali trattati potrebbe essere prevenuto ingegnerizzando geneticamente la carenza di IgE, un tipo di anticorpo, o somministrando loro un anticorpo anti-IgE per bloccare le azioni degli anticorpi IgE specifici per l’ovoalbumina prodotti dagli animali ” sistema immunitario. Al contrario, la presenza di anticorpi IgE specifici per l’ovoalbumina nel colon degli animali imitava l’effetto del dolore intestinale aumentato generato dopo l’ingestione di ovoalbumina, nei topi che non erano stati infettati da C. rodentium .
Aguilera-Lizarraga e colleghi hanno continuato a svelare alcuni dettagli molecolari alla base di questa risposta al dolore. Hanno dimostrato che dopo l’ infezione da C. rodentium e il trattamento con ovoalbumina, le cellule immunitarie nel colon del topo chiamate mastociti sono state sottoposte a degranulazione, un evento che rilascia molecole, inclusa l’istamina, necessarie per la difesa. Se questo processo è stato bloccato, utilizzando un farmaco che previene la degranulazione dei mastociti o mediante l’ingegneria genetica dei topi per la mancanza di mastociti, ciò ha ridotto o prevenuto il dolore intestinale aumentato che gli animali hanno sperimentato durante l’ingestione di ovoalbumina dopo l’infezione.
Gli autori presentano prove che indicano che il rilascio di istamina innesca il dolore influenzando i neuroni sensoriali nell’intestino. Il liquido surnatante prelevato dai due punti di questi topi ha aumentato la sensibilità in vitro dei neuroni sensoriali che segnalano il dolore. Questo effetto potrebbe essere prevenuto utilizzando un farmaco per bloccare il recettore dell’istamina H 1 , che si trova sui neuroni sensoriali, o utilizzando topi geneticamente modificati per non avere questo recettore.
Gli autori hanno successivamente iniettato soluzioni di soia, grano, glutine e latte – che sono stati tutti collegati ad allergie alimentari e possono causare sintomi intestinali, tra cui gonfiore e dolore addominale 7 – direttamente nel colonetto di 12 persone che avevano IBS e 8 individui sani . Tutti quelli con IBS, ma solo due degli individui sani, hanno mostrato segni di una reazione immunitaria ad almeno uno degli alimenti. Le persone con IBS avevano più mastociti in prossimità delle fibre nervose rispetto agli individui sani, suggerendo un trasferimento più efficace di informazioni tra i mastociti e le terminazioni nervose dei neuroni sensoriali.
Gli autori riferiscono che il 23% dei campioni fecali di persone con IBS erano positivi per l’infezione da parte del batterio Staphylococcus aureus , rispetto al solo 9% di soggetti sani. Questa scoperta è intrigante perché S. aureus è una delle principali fonti microbiche di “superantigeni”, potenti antigeni che sono stati collegati all’attivazione aspecifica di cellule immunitarie chiamate cellule T 9 . Infatti, il 47% dei campioni fecali di persone con IBS era positivo per almeno un superantigene, rispetto a solo il 17% di tali campioni di volontari sani. Questi risultati potrebbero suggerire che una precedente infezione e la presenza di superantigeni promuovono un aumento del dolore intestinale in alcune persone con IBS innescando la loro risposta del sistema immunitario.I sensori del dolore intestinale aiutano a combattere le infezioni
Lo studio degli autori solleva diversi punti per ulteriori considerazioni. Ad esempio, i meccanismi coinvolti sono stati determinati utilizzando l’ingestione di un antigene nei topi, mentre le soluzioni alimentari testate sull’uomo sono state iniettate direttamente nella mucosa intestinale (membrane mucose). Sarebbe interessante determinare se diete umane specifiche contenenti gli ingredienti testati ricapitolino i risultati degli autori. Inoltre, questo meccanismo di rottura della tolleranza orale non spiega perché le donne abbiano una maggiore predisposizione allo sviluppo di IBS rispetto agli uomini 4. Sebbene lo studio di Aguilera-Lizarraga e colleghi abbia rilevanza per i meccanismi associati all’IBS post-infettiva (come nella gastroenterite), sarebbe interessante indagare se questo meccanismo è rilevante per altri tipi di IBS, come l’IBS predominante nella costipazione, la diarrea- IBS o IBS predominante con abitudini intestinali miste.
Gli autori hanno utilizzato C. rodentium come organismo patogeno per il loro sistema modello murino. Tuttavia, anche le infezioni da altri microrganismi dannosi, come Escherichia coli , Salmonella , Giardia e Shigella , possono precedere l’insorgenza di IBS. Studi epidemiologici clinici suggeriscono che le infezioni intestinali da parte di questi agenti patogeni aumentano la probabilità che una persona sviluppi l’IBS 10 .
Questo meccanismo si applica solo al colon-retto o è rilevante anche per altre regioni intestinali come lo stomaco, l’intestino tenue e il colon prossimale? In tal caso, e se lo stesso tipo di risposta immunitaria si verifica in altre sedi intestinali, potrebbero attivarsi diversi nervi sensoriali, innescando sintomi diversi, come nausea, disagio e gonfiore, che sono rilevanti per altri disturbi del dolore intestinale, ad esempio un condizione chiamata dispepsia funzionale 4 .
Il lavoro di Aguilera-Lizarraga e colleghi presenta numerose potenziali opzioni da considerare per l’intervento terapeutico. Questi includono: migliorare la funzione di barriera intestinale per ridurre l’accesso intestinale al sistema immunitario intestinale; bersagliare gli anticorpi IgE specifici per la sostanza alimentare di interesse; ridurre la degranulazione dei mastociti; prendere di mira le molecole rilasciate dai mastociti o dai recettori su cui agiscono; e bloccando i nervi sensoriali del colon che trasmettono le informazioni nocive e causano dolore.
Da un punto di vista dietetico, si può riacquistare la tolleranza orale una volta persa? A questo proposito, studi sull’allergia alimentare suggeriscono che eliminare gli alimenti offensivi dalla dieta delle persone, e poi reintrodurli gradualmente, può migliorare la prognosi a lungo termine 11 . Le diete di esclusione sono sempre più popolari per porre rimedio ai sintomi gastrointestinali, comprese le diete prive di glutine per la celiachia e, per IBS, le diete a basso contenuto di un gruppo di carboidrati che non sono completamente digeriti o assorbiti nell’intestino (chiamati FODMAP – molecole fermentescibili di oligosaccaridi, disaccaridi , monosaccaridi e polioli) 12 . Lo studio di Aguilera-Lizarraga e colleghi fornisce informazioni sui meccanismi alla base del dolore addominale e dà un significato aggiunto al detto “tu sei quello che mangi”.
Nature 590 , 41-43 (2021)doi: https://doi.org/10.1038/d41586-020-03661-y
Riferimenti
- 1.Basbaum, A., Bautista, DM, Scherrer, G. & Julius, D. cellulare 139 , 267-284 (2009).
- 2.Aguilera-Lizarraga, J. et al. Nature 590 , 151–156 (2021).
- 3.Kobayashi, T. et al. Nature Rev. Dis. Primer 6 , 74 (2020).
- 4.Enck, P. et al. Nature Rev. Dis. Primers 2 , 16014 (2016).
- 5.Mars, RAT et al. Cella 182 , 1460–1473 (2020).
- 6.Grundy, L., Erickson, A. & Brierley, S. M. Annu. Rev. Physiol. 81, 261–284 (2019).
- 7.Nowak‑Wegrzyn, A., Szajewska, H. & Lack, G. Nature Rev. Gastroenterol. Hepatol. 14, 241–257 (2017).
- 8.Mowat, A. M. Nature Rev. Immunology. 18, 405–415 (2018).
- 9.Thammavongsa, V., Kim, H. K., Missiakas, D. & Schneewind, O. Nature Rev. Microbiol. 13, 529–543 (2015).
- 10.Spiller, R. & Garsed, K. Gastroenterology 136, 1979–1988 (2009).
- 11.Yu, W., Hussey Freeland, D. M. & Nadeau, K. C. Nature Rev. Immunol. 16, 751–765 (2016).
- 12.Moayyedi, P., Simrén, M. & Bercik, P. Nature Rev. Gastroenterol. Hepatol. 17 , 406–413 (2020).


